
Summary
El pertecnetato de sodio es un compuesto inorgánico de fórmula NaTcO4. Esta sal incolora contiene el anión pertecnetato, TcO−
4 que presenta una simetría tetraédrica ligeramente distorsionada tanto a 296 K como a 100 K,[2] mientras que el poliedro de coordinación del catión sodio difiere del típico de la estructura de la scheelita. El el anión 99mTcO−
4 radiactivo es un radiofármaco importante para uso diagnóstico. Las ventajas del 99mTc Entre se encuentran su corta vida media de 6 horas y la baja exposición del paciente a la radiación, lo que permite inyectarle al paciente actividades de más de 30 milicuries (1,100 MBq). [3] Na[99mTcO
4] es un precursor de una variedad de derivados que se utilizan para obtener imágenes de diferentes partes del cuerpo.
| Pertecnetato de sodio | ||
|---|---|---|
 Estructura Química | ||
 Estructura Tridimensional | ||
| Nombre IUPAC | ||
| Tetraoxotecnetato(VII) de sodio | ||
| General | ||
| Fórmula estructural |
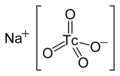 | |
| Fórmula molecular | NaTcO4 | |
| Identificadores | ||
| Número CAS | 13718-28-0[1] | |
| ChemSpider | 64887107 | |
| PubChem | 74086836 | |
| UNII | A0730CX801 | |
|
[Na+].[O-][Tc](=O)(=O)=O
| ||
|
InChI=InChI=1S/Na.4O.Tc/q+1;;;;;-1
Key: PTYSEDFCDJPPHO-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | sólido blanco o rosa palido | |
| Masa molar | 169,89 g/mol | |
| Punto de fusión | 790 °C (1063 K) | |
| Estructura cristalina | Scheelita | |
| Propiedades químicas | ||
| Solubilidad en agua | soluble | |
| Compuestos relacionados | ||
| otros Aniones | Permanganato de sodio, Perrenato de sodio | |
| Otros Cationes | Pertecnetato de amonio | |
| Compuestos relacionados | Óxido de tecnecio (VII) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Química
editarEl TcO4¯ es el material de partida para la mayor parte de la química del tecnecio. Las sales de pertecnetato suelen ser incoloras.[4] El TcO4¯ se produce mediante la oxidación del tecnecio con ácido nítrico o peróxido de hidrógeno. El anión pertecnetato es similar al anión permanganato, pero es un agente oxidante más débil. Es tetraédrico y diamagnético. El potencial de electrodo estándar para el TcO4¯/TcO2 es de tan solo +0,738 V en solución ácida, en comparación con los +1,695 V para el MnO4¯/MnO2.[5] Debido a su reducido poder oxidante, el TcO4¯ es estable en solución alcalina. El TcO4¯ es más similar al ReO4¯. Dependiendo del agente reductor, el TcO4¯ puede convertirse en derivados que contienen Tc(VI), Tc(V) y Tc(IV).[6] En ausencia de ligandos complejantes fuertes, el TcO4¯ se reduce a un estado de oxidación +4 mediante la formación de hidrato de TcO4¯.[7]
Uso farmacéutico
editarLa vida media del 99mTc es lo suficientemente larga como para que la síntesis de marcado del radiofármaco y las mediciones gammagráficas se puedan realizar sin una pérdida significativa de radiactividad. [3] La energía emitida desde 99mTc es de 140 keV, lo que permite el estudio de órganos profundos del cuerpo. Los radiofármacos no tienen un efecto farmacológico previsto y se utilizan en concentraciones muy bajas. Los radiofármacos que contienen 99mTc se utiliza actualmente para determinar la morfología de los órganos, evaluar su función y obtener imágenes gammagráficas y tomográficas por emisión. La radiación gamma emitida por el radionúclido permite obtener imágenes tomográficas de los órganos in vivo . Actualmente, más del 80 % de los radiofármacos de uso clínico están marcados con 99mTc . La mayoría de los radiofármacos marcados con 99mTc se sintetizan mediante la reducción del ion pertecnetato en presencia de ligandos seleccionados para conferirle especificidad orgánica al fármaco. El 99mTc resultante99mTc Luego se inyecta el compuesto 99mTc en el cuerpo y se enfoca una "cámara gamma" en secciones o planos para obtener imágenes de la distribución espacial del 99mTc .
Aplicaciones específicas de imágenes
editarEl 99mTc se utiliza principalmente en el estudio de la glándula tiroides: su morfología, vascularidad y función. El TcO−⁻ y el yoduro, debido a su comparable relación carga/radio, se incorporan de forma similar a la glándula tiroides. El ion pertecnetato no se incorpora a la tiroglobulina. También se utiliza en el estudio de la perfusión sanguínea, la acumulación regional y las lesiones cerebrales, ya que se acumula principalmente en el plexo coroideo.
El pertecnetato de sodio no puede atravesar la barrera hematoencefálica . Además de las glándulas salivales y tiroideas, 99mTcO−
4 se localiza en el estómago. 99mTcO−
4 se elimina por vía renal durante los tres primeros días tras la inyección. Tras la gammagrafía, se recomienda que el paciente beba abundante agua para acelerar la eliminación del radionúclido. [8] Otros métodos de 99mTcO−
4 La administración incluye vía intraperitoneal, intramuscular, subcutánea y oral. El comportamiento del 99mTcO−
4 ion es esencialmente el mismo, con pequeñas diferencias debidas a la diferencia en la tasa de absorción, independientemente del método de administración. [9]
Otras reacciones que involucran al ion pertecnetato
editar- Radiólisis de TcO−
4 en soluciones de nitrato procede a través de la reducción a TcO2−
4 que induce procesos complejos de desproporción:
- El pertecnetato puede reaccionar con H
2S para dar Tc
2S
7 . [10] - El pertecnetato también puede reducirse a compuestos de Tc(IV/V) en soluciones alcalinas en tanques de residuos nucleares sin añadir metales catalíticos, agentes reductores ni radiación externa. Reacciones de mono y disacáridos con 99mTcO−
4 producen compuestos de Tc(IV) que son solubles en agua. [11]
Referencias
editar- ↑ Número CAS
- ↑ German, K. E.; Grigoriev, M. S.; Garashchenko, B. L.; Kopytin, A. V.; Tyupina, E. A. (1 de julio de 2017). «Redetermination of the crystal structure of NaTcO4 at 100 and 296 K based on single-crystal X-ray data». Acta Crystallographica Section E: Crystallographic Communications (en inglés) 73 (7): 1037-1040. ISSN 2056-9890. PMC 5499285. PMID 28775877. doi:10.1107/S2056989017008362.
- ↑ a b Schwochau, K. (1994). «Technetium Radiopharmaceuticals-Fundamentals, Synthesis, Structure, and Development». Angew. Chem. Int. Ed. Engl. 33 (22): 2258-2267. doi:10.1002/anie.199422581. Error en la cita: Etiqueta
<ref>no válida; el nombre «schwochau» está definido varias veces con contenidos diferentes - ↑ Wells, A. F.; Structural Inorganic Chemistry; Clarendon Press: Oxford, Great Britain; 1984; p. 1050.
- ↑ Schwochau, K. (1994). «Technetium Radiopharmaceuticals-Fundamentals, Synthesis, Structure, and Development». Angew. Chem. Int. Ed. Engl. 33 (22): 2258-2267. doi:10.1002/anie.199422581.
- ↑ Encyclopædia Britannica: Technetium
- ↑ Schwochau, K. (1994). «Technetium Radiopharmaceuticals-Fundamentals, Synthesis, Structure, and Development». Angew. Chem. Int. Ed. Engl. 33 (22): 2258-2267. doi:10.1002/anie.199422581.
- ↑ Shukla, S. K., Manni, G. B., and Cipriani, C. (1977). «The Behaviour of the Pertechnetate Ion in Humans». Journal of Chromatography B 143 (5): 522-526. PMID 893641. doi:10.1016/S0378-4347(00)81799-5.
- ↑ Razzak, M. A.; Naguib, M.; El-Garhy, M. (1967). «Fate of Sodium Pertechnetate-Technetium-99m». Journal of Nuclear Medicine 8 (1): 50-59. PMID 6019138.
- ↑ Emeléus, H. J.; Sharpe, A. G. (1968). Advances in Inorganic Chemistry and Radiochemistry, Volume 11. Academic Press. p. 26. ISBN 978-0-08-057860-6.
- ↑ D. E. Berning, N. C. Schroeder and R. M. Chamberlin (2005). «The autoreduction of pertechnetate in aqueous, alkaline solutions». Journal of Radioanalytical and Nuclear Chemistry 263 (3): 613-618. Bibcode:2005JRNC..263..613B. doi:10.1007/s10967-005-0632-x.


