
Summary
El acetato de magnesio anhidro tiene la fórmula química Mg(CH3COO)2 y, en su forma hidratada, acetato de magnesio tetrahidratado, su fórmula química es Mg(CH3COO)2·4H2O. En este compuesto, el magnesio tiene un estado de oxidación de +2. El acetato de magnesio es la sal de magnesio del ácido acético.[2] Este es delicuescente y, al calentarse, se descompone para formar óxido de magnesio.[3] El acetato de magnesio se utiliza comúnmente como fuente de magnesio en reacciones biológicas.[4]
| Acetato de magnesio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Etanoato de magnesio | ||
| General | ||
| Fórmula semidesarrollada | Mg(CH3COO)2 | |
| Fórmula estructural |
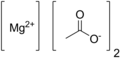 | |
| Fórmula molecular | Mg(C2H3O2)2 | |
| Identificadores | ||
| Número CAS |
142-72-3 (Anhídro) 16674-78-5 (tetrahidrato)[1] | |
| ChEBI | 62964 | |
| ChEMBL | 1200691 | |
| ChemSpider | 8556 | |
| DrugBank | DB13996 | |
| PubChem | 8896 | |
| UNII | 0E95JZY48K | |
|
InChI=InChI=1S/2C2H4O2.Mg/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2
Key: UEGPKNKPLBYCNK-UHFFFAOYSA-L | ||
| Propiedades físicas | ||
| Apariencia | cristales blancos higroscopicos | |
| Densidad | 1450 kg/m³; 1,45 g/cm³ | |
| Masa molar | 142,394 g/mol | |
| Punto de fusión | 80 °C (353 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | soluble | |
| Compuestos relacionados | ||
| Otros Cationes | Acetato de calcio | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas
editarEl acetato de magnesio se presenta en forma de cristales higroscópicos blancos. Huele a ácido acético y es soluble en agua. En solución acuosa, su pH es alcalino, casi neutro.[5][6]
Almacenamiento
editarDebido a su alta higroscopicidad, debe almacenarse lejos del agua. Además, es incompatible con oxidantes fuertes y no debe mezclarse con ellos.[7]
Síntesis
editarSíntesis de acetato de magnesio a partir de la reacción de hidróxido de magnesio con ácido acético.[8]
- 2 CH
3COOH + Mg(OH)
2 → Mg(CH
3COO)
2 + 2 H
2O
también se puede prepararse, haciendo una suspensión de carbonato de magnesio en agua destilada con solución de ácido acético al 20%.[9]
- 2 CH
3COOH + MgCO
3 → Mg(CH
3COO)
2 + CO
2 + H
2O
La reacción usando magnesio metálico con ácido acético disuelto en benceno seco, provoca la formación de acetato de magnesio junto con la liberación de hidrógeno gaseoso.[10]
- Mg + 2CH
3COOH → Mg(CH
3COO)
2 + H
2
Usos y aplicaciones
editarEn 1881, Charles Clamond inventó la cesta Clamond, una de las primeras mantas de gas eficaces. Los reactivos utilizados en esta invención incluían al propio acetato de magnesio, junto con hidróxido de magnesio y agua.
El acetato de magnesio se utiliza comúnmente como fuente de magnesio o para el ion acetato en experimentos químicos. Un ejemplo de esto es el uso de acetato de magnesio y nitrato de magnesio para realizar simulaciones de dinámica molecular y mediciones de tensión superficial. En el experimento, los autores descubrieron que el acetato tenía mayor afinidad por la superficie que el ion nitrato y que el Mg2+ repelía fuertemente la interferencia aire/líquido. También descubrieron que el Mg2+ tenía mayor tendencia a unirse al ion acetato que al nitrato.[11]
Uno de los usos más comunes del acetato de magnesio es la mezcla de acetato de calcio y magnesio (CMA). Se trata de una mezcla de acetato de calcio y acetato de magnesio. El CMA se considera un descongelante alternativo al NaCl y al CaCl2, que es más respetuoso con el medio ambiente. El CMA también actúa como un potente agente de control de emisiones de SO2, NO2 y partículas tóxicas en los procesos de combustión de carbón para reducir la lluvia ácida, y como un catalizador eficaz para facilitar la combustión del carbón.[12]
Se ha descubierto que el acetato de magnesio causa un cambio conformacional en la enzima Primasa de Escherichia coli. En este experimento, se compararon Mg(OAc)2, MnCl2, CaCl2, NaOAc, LiCl, MgSO4 y MgCl2 para determinar su efecto sobre la enzima Primasa de Escherichia coli. Los investigadores descubrieron que el Mg(OAc)2 causó el mayor cambio conformacional. El MgSO4 y el MgCl2 indujeron el efecto ligeramente, mientras que los demás no.[13]
Cuando el acetato de magnesio se mezcla con peróxido de hidrógeno, actúa como bactericida.[14]
Se ha demostrado que el acetato de magnesio es eficaz para incinerar compuestos orgánicos en preparación para un análisis de flúor cuando hay concentraciones altas o bajas de flúor.[15]
Seguridad
editarEl acetato de magnesio es un compuesto relativamente seguro de manipular y se le ha asignado una clasificación de riesgo para la salud de cero. Sin embargo, siempre debe manipularse con guantes y gafas de seguridad. Si entra en contacto con los ojos, la piel, se ingiere o se inhala, causará irritación en las áreas correspondientes: ojos, piel, sistema gastrointestinal y pulmones.[16]
Referencias
editar- ↑ (Anhídro)
16674-78-5 (tetrahidrato) Número CAS - ↑ Magnesium Acetate. Hazard.com. Retrieved on 2012-04-12.
- ↑ Magnesium Acetate Supplier & Tech Info American Elements Retrieved on 2012-04-12.
- ↑ «Sigma-Aldrich fact sheet on Magnesium acetate». Consultado el 26 de abril de 2012.
- ↑ «Unisenchem Fact Sheet Magnesium Acetate». Consultado el 27 de abril de 2012.
- ↑ «Unisenchem Fact Sheet Magnesium Acetate». Archivado desde el original el 8 de julio de 2010. Consultado el 16 de diciembre de 2013.
- ↑ «Unisenchem Fact Sheet Magnesium Acetate». Consultado el 27 de abril de 2012.
- ↑ Stouffer, M. R. «. Adsorbents for removing H2s, Other Odor causing Compounds, and Acid Gases from Gas Streams and Methods for Producing and Using these Adsorbents». Consultado el 25 de abril de 2012.
- ↑ Staszczuk, P.; Pekalska, J. (2003). «Methods of Preparation of Magnesium Organic Compounds from Natural Dolomite». Physiochemical Problems of Mineral Processing 37: 149-158.
- ↑ Encyclopedia of Chemical Reactions. 1957. p. 399.
- ↑ Minofar, Babak; Vácha, Robert; Wahab, Abdul; Mahiuddin, Sekh; Kunz Werner; Jungwirth, Pavel (2006). «Propensity for the Air/Water Interface and Ion Pairing in Magnesium Acetate vs Magnesium Nitrate Solutions: Molecular Dynamics Simulations and Surface Tension Measurements». J. Phys. Chem. 110 (32): 15939-15944. PMID 16898748. doi:10.1021/jp060627p.
- ↑ Dionysiou, Dionysios; Tsianou, Marina; Botsaris, Gregory (2000). «Extractive Crystallization for the Production of Calcium Acetate and Magnesium Acetate from Carbonate Sources». Ind. Eng. Chem. Res. 39 (11): 4192-4202. doi:10.1021/ie9906823.
- ↑ Urlacher, Teresa M.; Griep, Mark A. (1995). «Magnesium Acetate Induces a Conformational Change in Escherichia coli Primase». Biochemistry 34 (51): 16708-16714. PMID 8527445. doi:10.1021/bi00051a020.
- ↑ Vigo, T. L, Danna, G. F. «Reaction Products of Magnesium Acetate and Hydrogen Peroxide for Imparting Antibacterial Activity to Fibrous Subtrates». Patent. Consultado el 26 de abril de 2012.
- ↑ Crutchfield, W. Jr. (1942). «Magnesium Acetate as an Ashing Agent in Fluorine Analysis». Ind. Eng. Chem. Anal. Ed. 14: 57-58. doi:10.1021/i560101a023.
- ↑ «Sigma-Aldrich material safety sheet». www.lakeland.edu. 7 de febrero de 2009.


