
Summary
Las septinas (del inglés "septins"), consideradas el cuarto componente del citoesqueleto,[1] se asocian, con un alto grado de orden, pueden ensamblarse en filamentos, anillos y mallas, proporcionando un andamiaje para los otras proteínas. Las SEPT fueron descritas en levaduras brotantes como filamentos en el cuello de la levadura madre. Proteínas con secuencias homólogas han sido identificadas en células eucariotas desde levaduras hasta animales incluyendo al hombre, pero no han sido descritas en plantas.[2] Las septinas (SEPT) tienen, en el humano un promedio de 470 aminoácidos y un peso promedio de 53 000 Daltons.
| Familia Septinas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Nomenclatura |
Otros nombres Cell Division GTP binding protein
| ||||||||
| Identificadores externos | |||||||||
| |||||||||
| Estructura/Función proteica | |||||||||
| Tamaño | 358 a 586 (humana) (aminoácidos) | ||||||||
| Peso molecular | 40.704 a 65.401 (Da) | ||||||||
| Estructura | micro | ||||||||
| Funciones | Estructurales | ||||||||
| Dominio proteico | Unión a nucleótidos | ||||||||
| Motivos |
Hélice alfa, Beta strand, Bucles flexibles, P-loops (motivos Walker) | ||||||||
| Ortólogos | |||||||||
| Especies |
| ||||||||
| Ubicación (UCSC) |
| ||||||||
Características
editarLas septinas (SEPT) son proteínas nucleósido-trifosfatasa (NTPasas) que se unen específicamente al GTP. Se incluyen en el grupo (E.C.:3.6.5) Este grupo comprende sistemas de hidrolización de GTP.
Las septinas de los mamíferos se clasifican en cuatro grupos: SEPT2, SEPT6, SEPT7 y SEPT9 muchas de estas septinas existen en múltiples isoformas.[3]
Todas las septinas contienen motivos de unión a fosfato (GTP).
EC 3.6.5.1 heterotrimeric G-protein GTPasa; EC 3.6.5.2 small monomeric GTPasa; EC 3.6.5.3 protein-synthesizing GTPasa; EC 3.6.5.4 signal-recognition-particle GTPasa; EC 3.6.5.5 dinamin GTPasa; EC 3.6.5.6 tubulin GTPasas.[4]
Genes
editarEl número de genes que codifican para las septinas varía ampliamente entre los diferentes organismos, por ejemplo para el gusano Caenorhabditis elegans se conocen 2, en el hongo Encephalitozoon cuniculi 3, en la mosquita Drosophila melanogaster 5, en la levadura S. cerevisiae 7, Homo sapiens 14 y en pez cebra Danio rerio 17 genes.[2]
Los 13 genes de septinas de los mamíferos se clasifican en cuatro grupos:
- grupo SEPT2 (SEPT1, SEPT2, SEPT4 y SEPT5),
- grupo SEPT6 (SEPT6, SEPT8, SEPT10, SEPT11 y SEPT14),
- grupo SEPT7 y
- grupo SEPT9 (SEPT3, SEPT9 y SEPT12);
muchas de estas septinas existen en múltiples isoformas.[3]
Los motivos de unión a fosfato que reciben diferentes denominaciones: G1 (motivo Walker A; G3 (motivo Walker B) y G4 (motivo de especificidad a GTP) están altamente conservados.
Estructura
editarLas septinas son un grupo de proteínas que contienen una región conservada de unión a GTP, además todas pueden formar complejos heteroméricos, los cuales se asocian con un alto grado de orden estructural.
Las septinas varían principalmente en la longitud y composición de aminoácidos de sus colas N-terminales, que contienen dominios proteicos ricos en prolina y de sus colas C-terminales que contienen bobinas enrolladas α-hélices (coiled coils).
El dominio de unión a nucleótidos está formado por hélices α y hebras β (β-strands) alternadas, separadas por bucles flexibles, que contienen motivos de secuencia que interactúan con los grupos fosfato de GTP o ATP.
El motivo Walker A, también conocido como bucle de Walker, bucle P o bucle de unión a fosfato (P-loop) o G1. El motivo tiene el patrón Gxxxx-GK-[TS], donde G, K, T y S denotan residuos de glicina, lisina, treonina y serina respectivamente, y x denota cualquier aminoácido.
El motivo Walker B (o G3) tiene el patrón DxxG.
El motivo de especificidad a GTP (o G4) tiene patrón NKxD (donde K es lisina y x cualquier aminácido). [3]
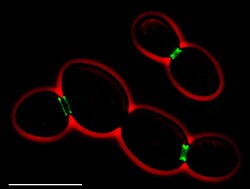
Filamentos, anillos y horquillas en forma de reloj de arena,[5] se localizan en el sitio de división de la membrana plasmática, en los anillos de los espermatozoides y en la base de los cilios y dendritas.
Las septinas también pueden asociarse con los filamentos de actina, microtúbulos y con fosfolípidos de la membrana.[1] Sin embargo, al igual que los filamentos intermedios, las septinas no presentan polaridad. Aunque se cree que no contribuyen en la generación de fuerza contráctil, se tiene evidencia de su participación en diferentes procesos celulares como la citogénesis, ciliogénesis, neurogénesis, migración celular, mitosis, crecimiento y polarización de las células.
Las septinas actúan como andamio y participan en el reclutamiento y organización de proteínas, actuando como barrera de difusión para separar distintos dominios en las membrana,[1] evitando la difusión de factores de la citocinesis, proteínas y RNAs ente la célula madre e hija.[5]
Levaduras
editarLas septinas fueron descritas en levaduras brotantes de Saccharomyces cerevisiae como filamentos en el cuello de la levadura madre, estas observaciones fueron realizadas durante estudios de control genético del ciclo de división celular.[6]
Bacterias
editarEn bacterias, las paraseptinas son proteínas relacionadas con las septinas, estas últimas se especula que fueron adquiridas por las células eucariotas por transferencia lateral de bacterias.[7]
Coanoflagelados
editarEn el coanoflagelado Salpingoeca rosetta, considerado como uno de los parientes más cercanos de los animales, la septina (Septin2) se encuentra «enriquecida» en el polo basal de células individuales y de colonias tipo rosetas, en los puntos de contacto entre células adyacentes.[8]
Importancia
editarEl mal funcionamiento de estas proteínas está relacionado con enfermedades neurodegenerativas (Alzheimer y Parkinson), cáncer (colon, oral, leucemias) e infertilidad masculina; por lo cual es importante el estudio de estas proteínas como componentes del citoesqueleto.[1]
Referencias
editar- ↑ a b c d Mostowy S.; Cossart P. (2012 Feb 8). «Septins: the fourth component of the cytoskeleton.». Nat Rev Mol Cell Biol. (REVISIÓN) 13 (3). doi:10.1038/nrm3284. Parámetro desconocido
|páginas de las personas as=ignorado (ayuda) - ↑ a b Pan F, Malmberg RL, Momany M. (2007 Jul 1). «Analysis of septins across kingdoms reveals orthology and new motifs.». BMC Evol Biol. 7: 103.
- ↑ a b c Dolat, Lee; Hu, Qicong; Spiliotis Elias T. (2014 Feb). «Septin functions in organ system physiology and pathology». Biol Chem. 395 (2): 123–141. doi:10.1515/hsz-2013-0233. Consultado el 26 de mayo de 2025.
- ↑ Enzyme Nomenclature. Recommendations EC 3.6.5. Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB).
- ↑ a b Oh Y.; Bi E. (2011). «Septin structure and function in yeast and beyond.». Trends Cell Biol. 21 (3): 141-148. doi:10.1016/j.tcb.2010.11.006.
- ↑ Hartwell LH. (1971). «Genetic control of the cell division cycle in yeast. IV. Genes controlling bud emergence and cytokinesis.». Exp Cell Res. 69 (2): 265-276.
- ↑ Cao L. ; Yu W. ; Wu Y. ; Yu L. (2009 Jul 14). The evolution, complex structures and function of septin proteins fe Sci. 66 (20). pp. 3309-3323. doi:10.1007/s00018-009-0087-2. Consultado el 26 de mayo de 2025.
- ↑ Booth, David S.; Szmidt-Middleton, Heather; King, Nicole (2018). «Transfection of choanoflagellates illuminates their cell biology and the ancestry of animal septins». Molecular Biology of the Cell 29 (25): 3026-3038. doi:10.1091/mbc.E18-08-0514. Consultado el 23 de mayo de 2025.
Enlaces externos
editar- Enzime nomenclature. EC 3.6.5 GTPasas Acting on GTP; involved in cellular and subcellular movement.


