
Summary
El perfluoroheptano o hexadecafluoro-n-hexano es un compuesto químico formado por una cadena de 7 átomos de carbono (heptano) donde los átomos de hidrógeno han sido totalmente sustituidos por átomos de flúor. Su fórmula molecular es C7F16.
| Perfluoroheptano | ||
|---|---|---|
 Molécula del Perfluoroheptano | ||
 Modelo de bolas del Perfluoroheptano | ||
| Nombre IUPAC | ||
| 1,1,1,2,2,3,3,4,4,5,5,6,6,7,7,7-hexadecafluoroheptano | ||
| General | ||
| Otros nombres | perfluoroheptano, perfluoro-n-heptano | |
| Fórmula semidesarrollada | CF3- CF2-CF2-CF2-CF2-CF2-CF3 | |
| Fórmula estructural |
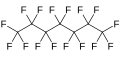 | |
| Fórmula molecular | C7F16 | |
| Identificadores | ||
| Número CAS | 355-57-9[1] | |
| ChEBI | 38847 | |
| ChemSpider | 9179 | |
| PubChem | 9553 | |
| UNII | I23ZVD1P1L | |
|
InChI=InChI=1S/C7F16/c8-1(9,2(10,11)4(14,15)6(18,19)20)3(12,13)5(16,17)7(21,22)23
Key: LGUZHRODIJCVOC-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | incoloro, inodoro | |
| Densidad | 0,001706 a 25 °C kg/m³; 1,706 a 25 °C g/cm³ | |
| Masa molar | 388,05 g/mol | |
| Punto de fusión | 222 K (−51 °C) | |
| Punto de ebullición | 355,3 K (82 °C) | |
| Temperatura crítica | 475,3 K (202 °C) | |
| Presión crítica | 1,62 atm | |
| Viscosidad | 0,938 mPa/s a 25 °C | |
| Índice de refracción (nD) | 1,2670 a 25 °C | |
| Propiedades químicas | ||
| Solubilidad en agua | Inmiscible | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Pertenece a la familia de los perfluorocarburos (PFC) o perfluoroalcanos, cuya fórmula molecular general es CnF2n+2, n = 5-9.[2]
La sustitución de los átomos de hidrógeno por átomos de flúor tiene una profunda influencia sobre las propiedades físicas y químicas de estos compuestos. Debido a dichas propiedades físico-químicas el perfluoroheptano presenta una menor toxicidad, es más seguro y menos contaminante que los disolventes convencionales, incluyéndose en la categoría de disolvente neotérico.
Un poco de historia
editarLos perfluorocarburos, entre los que se encuentra el perfluoroheptano, fueron sintetizados por primera vez en 1920, si bien su desarrollo industrial no llegó hasta los años 40.
Sin embargo su verdadero impulso vino a partir de 1990, cuando entró en vigor el Protocolo de Montreal.[3][4] A diferencia de los clorofluorocarburos (CFCs), hidroclorofluorocarburos (HCFC) y otros halones los PFC no causan daños a la capa de ozono, es por ello que comenzaron a usarse como sus sustitutos en distintas aplicaciones.
Propiedades físico-químicas
editarEl perfluoroheptano es un disolvente líquido con unas propiedades físico-químicas únicas debido la presencia de enlaces C-F, los enlaces sencillos más fuertes encontrados en química orgánica.[5] Mientras que sus enlaces intramoleculares son fuertes, los enlaces intermoleculares (entre moléculas) son débiles. Esto explica algunas de sus propiedades como la temperatura de ebullición, menor que su alcano análogo (el heptano) a pesar de tener una masa molecular mucho mayor.
El perfluoroheptano es incoloro, ignífugo, inerte y no corrosivo.[6] Es capaz de disolver numerosas sustancias apolares. Es insoluble e inmiscible con agua, por lo que no se disuelve en masas acuosas, pero como veremos en el apartado de toxicidad su carácter apolar y su gran estabilidad tanto química como térmica hace muy complicada su descomposición, tendiendo a bioacumularse.
Aplicaciones
editarDisolventes de limpieza en electrónica
editarA pesar de que los perfluorocarburos disuelven peor las grasas e impurezas presentes en los materiales electrónicos, se emplean como sustituyes de disolventes clorados como CFC-113 y 1,1,1-tricloroetano o HCFC y HFC[7] debido a su baja toxicidad y su buena solubilidad de grasas y compuestos apolares.
Disolventes en aerosoles
editarEl perfluoroheptano puede emplearse como Propelente de aerosol, en sustitución de los CFC y los HCFC, debido a su densidad y su presión de vapor. Tiene la ventaja de que no es inflamable y no destruye la capa de ozono.
Fluido transmisor de calor
editarLos fluidos transmisores de calor se emplean como su propio nombre indica en sistemas donde es necesario retirar calor, como en neveras o supercomputadores. A pesar de que existen otros fluidos transmisores de calor, como el agua desionizada, el perfluoroheptano y otros perfluorocarburos tienen la ventaja de ser compatibles con numerosos materiales debido a su carácter inerte y tener unas excelentes propiedades dieléctricas.[8]
Agente supresor de incendios
editarHasta 1990 los agentes supresores de incendios más extendidos eran los halones, sin embargo con la entrada en vigor del protocolo de Montreal su uso se prohibió. El perfluoroheptano es un líquido con una baja conductividad y no deja residuos tras la extinción. Sin embargo a altas temperaturas los perfluorocarburos pueden descomponer liberando moléculas altamente tóxicas como el perfluoroisobutano.[9]
Medicina
editarLas aplicaciones del perfluoroheptano en medicina son múltiples:
- Propelentes en inhaladores[10][4]
- Agentes de contraste en técnicas como los ultrasonidos[11]
- Para sustituir al humor vítreo en cirugías oculares y en tratamientos de desprendimiento de retina[12]
- Como encapsulante de fármacos en la preparación de microcápsulas[13]
Toxicidad
editarComo ya habíamos avanzado, a pesar de que los perfluorocarburos líquidos están considerados compuestos no tóxicos, hay estudios que demuestran que a elevadas temperaturas pueden descomponer en pequeñas moléculas que pueden ser tóxicas[14]
En la pirólisis del perfluoroheptano se obtienen compuestos como tetrafluorometano (CF4), tetrafluoroetileno (C2F4), hexafluoroetano (C2F6), hexafluoropropeno (C3F6) y perfluoroisobutileno (C4F3). El tetrafluoroetileno presenta toxicidad crónica y es carcinógeno, mientras que el perfluoroisobutileno es unas 10 veces más tóxico que el fosgeno y su inhalación puede causar serios daños pulmonares.[15] Esto hace que la manipulación de estos compuestos presente un riesgo en caso de incendios o accidentes industriales.
Debido a la alta estabilidad de los perfluorocarburos líquidos su degradabilidad en el medioambiente es muy baja por lo que permanecen en el mismo durante mucho tiempo.[16] Por otro lado están catalogados como potentes gases de efecto invernadero y son unos de los 6 objetivos del Protocolo de Kioto.[17]
Por último pese a ser insoluble en medio acuoso (su solubilidad es 5’7·10-7 mol/L) el perfluoroheptano puede contaminar acuíferos y masas de agua por acumulación en los niveles más profundos debido a su alta densidad (1’706 g/cm³).[18]
Referencias
editar- ↑ Número CAS
- ↑ [Sandford G. Perfluoroalkanes. Tetrahedron 2003;59:437-454.
- ↑ Marino FA. A new process alternative for replacing ozone-depleting solvent cleaners. Plat Surf Finish 1993;80(4):41–5.
- ↑ a b Leach CL. Approaches and challenges to use freon propellant replacements. Aerosol SciTechnol 1995;22:328–34.
- ↑ Haszeldine RN, Smith F. Organic fluorides. Part VI. The chemical and physical properties of certain fluorocarbons. J Chem Soc 1951:603–8
- ↑ Oliver GD, Blumkin S, Cunningham CW. Some physical properties of hexadecafluoroheptane. J Am Chem Soc 1951;73:5722–5
- ↑ [Tsai WT, Chen HP, Hsien WY. A review of uses, environmental hazards and recovery/recycle technologies of perfluorocarbons (PFCs) emissions from the semiconductor manufacturing processes. J Loss Prev Process Ind 2002;15:65–75.
- ↑ [Park YJ, Kim CJ, Hong SE. A study of the heat transfer characteristics of an FC-72 (C6F14) two-phase closed thermosyphon with helical grooves on the inner surface. Heat Transfer Eng 2004;25:60–8.
- ↑ [O'Mahony TKP, Cox AP, Roberts DJ. Quantitative analysis of the pyrolysis products of perfluorocarbon fluids by gas chromatography and spectroscopic techniques. Anal Proc 1993;30:262–6.
- ↑ [Jones SA, Martin GP, Brown MB. High-pressure aerosol suspensions — a novel laser diffraction particle sizing system for hydrofluoroalkane pressurised metered dose inhalers. Intern J Pharm 2005;302:154–65.
- ↑ [Hall CS, Lanza GM, Rose JH, Kaufmann RJ, Fuhrhop RW, Handley SH, et al. Experimental determination of phase velocity of perfluorocarbons: applications to targeted contrast agents, IEEE Trans. Ultrason Ferroelect Freq Contr 2000;47:75–84.
- ↑ [Peyman GA, Schulman JA, Sullivan B. Perfluorocarbon liquids in ophthalmology. Surv Ophthalmol 1995;39:375–95.
- ↑ [Mana Z, Pellequer Y, Lamprecht A. Oil-in-oil microencapsulation technique with an external perfluorohexane phase. Int J Pharm 2007;338:231–7.
- ↑ [Zundorf J, Kremer S, Gruger T. Formation of hydrogen fluoride by gamma and beta sterilisation in medical devices containing perfluoroheptane. Toxicology 2008;243:284–93.
- ↑ [Wang H, Ding R, Ruan J, Yuan B, Sun X, Zhang X, et al. Perfluoroisobutylene-induced acute lung injury and mortality are heralded by neutrophil sequestration and accumulation. J Occup Health 2001;43:331–8.
- ↑ [Ravishankara AR, Solomon S. Turnipseed AA., Warren RF. Atmospheric lifetimes of long-lived halogenated species. Science 1993; 259:194-199
- ↑ [Tsai WT. Environmental hazards and health risk of common liquid perfluoro-n-alkanes, potent greenhouse gases. Environmental International 2009; 35: 418-424
- ↑ [Tsai WT. An overview of environmental hazards and exposure risk of hydrofluorocarbons (HFCs). Chemosphere 2005;61:1539–47.
Enlaces externos
editar- Intergovernmental Panel on Climate Change (IPCC): Climate change 2007— the physical science basis.
- Ficha de Seguridad del perfluoroheptano


