
Summary
El estannato sódico, formalmente hexahidroxostanato (IV) de sodio, es un compuesto inorgánico de fórmula Na2[Sn(OH)6].
| Estannato de sodio | ||
|---|---|---|
| General | ||
| Fórmula estructural |
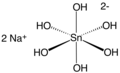 | |
| Fórmula molecular | Na2[Sn(OH)6] | |
| Identificadores | ||
| Número CAS | 12027-70-2[1] | |
| ChemSpider | 10732930 | |
| PubChem | 21977542 | |
| UNII | NJ7C1V83KG | |
|
InChI=InChI=1S/2Na.3H2O.3O.Sn/h;;3*1H2;;;;/q2*+1;;;;;2*-1;
Key: SFXJSNATBHJIDS-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Densidad | 4680 kg/m³; 4,68 g/cm³ | |
| Masa molar | 267,898 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Esta sal incolora se obtiene al disolver estaño metálico u óxido de estaño (IV) en hidróxido de sodio y se utiliza como estabilizador del peróxido de hidrógeno.[2]
En la bibliografía más antigua, los estannatos se representan a veces como si tuvieran el oxianión simple SnO32−,[3] en cuyo caso este compuesto se denomina estannato de sodio-3-agua y se representa como Na2SnO3·3H2O, un hidrato con tres aguas de cristalización.
La forma anhidra del estannato sódico, Na2SnO3, se reconoce como un compuesto distinto con su propio número de registro CAS (12058-66-1) [4] y una ficha de datos de seguridad de materiales distinta. [5]
Los compuestos de estannato de metales alcalinos se preparan disolviendo estaño elemental en un hidróxido metálico adecuado. En el caso del estanato sódico, la reacción es la siguiente:[6]
- Sn + 2 NaOH + 4 H2O → Na2[Sn(OH)6] + 2 H2
Una reacción similar ocurre cuando el dióxido de estaño se disuelve en una base:
- SnO2 + 2 NaOH + 2 H2O → Na2[Sn(OH)6]
La forma anhidra también puede prepararse a partir de dióxido de estaño tostado carbonato de sodio en un entorno mixto de monóxido de carbono/ dióxido de carbono:[7]
- SnO2 + Na2CO3 → Na2SnO3 + CO2
El anión es un complejo de coordinación de forma octaédrica, similar a la mayoría de los estannatos, como el hexacloroestannato [SnCl6]2−. La distancia media entre los enlaces Sn-O es de 2,071 Å. [8]
Véase también
editarReferencias
editar- ↑ Número CAS
- ↑ Clark, John D. (1972). Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press. ISBN 0813507251.
- ↑ Similarly, stannites are sometimes represented with the anion SnO22−
- ↑ National Center for Biotechnology Information (2017). «Sodium Stannate». PubChem. Consultado el 1 de junio de 2017.
- ↑ «Sodium Stannate MSDS». Santa Cruz Biotechnology. 14 de junio de 2011. Consultado el 1 de junio de 2017.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd edición). Butterworth-Heinemann. ISBN 0750633654.
- ↑ Zhang, Yuanbo; Su, Zijian; Liu, Bingbing; You, Zhixiong; Yang, Guang; Li, Guanghui; Jiang, Tao (2014). «Sodium stannate preparation from stannic oxide by a novel soda roasting–leaching process». Hydrometallurgy (journal) 146: 82-88. Bibcode:2014HydMe.146...82Z. doi:10.1016/j.hydromet.2014.03.008.
- ↑ Jacobs, Herbert; Stahl, Rainer (2000). «Neubestimmung der Kristallstrukturen der Hexahydroxometallate Na2Sn(OH)6, K2Sn(OH)6 und K2Pb(OH)6». Z. Anorg. Allg. Chem. (en alemán) 626 (9): 1863-1866. doi:10.1002/1521-3749(200009)626:9<1863::AID-ZAAC1863>3.0.CO;2-M.
Enlaces externos
editar- Esta obra contiene una traducción derivada de «Sodium stannate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


