
Summary
En química, los complejos metálicos acuosos o aquacomplejos son compuestos de coordinación que contienen iones metálicos con agua únicamente como ligando. Estos complejos son las especies predominantes en soluciones acuosas de muchas sales metálicas, como nitratos, sulfatos y percloratos metálicos. Tienen la estequiometría general [M(H
2O)
n]z+
. Su comportamiento sustenta muchos aspectos de la química ambiental, bioquímica e industria química. Este artículo se centra en los complejos en los que el agua es el único ligando ("complejos aquo homolépticos"), pero, por supuesto, se sabe que muchos complejos consisten en una mezcla de aquo junto a otros ligandos.[1][2]
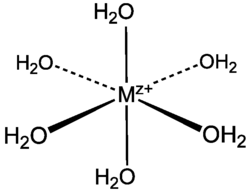

Estequiometría y estructura
editarComplejos hexa-aquo
editarLa mayoría de los complejos acuosos metálicos (aquacomplejos) son mononucleares, con la fórmula general [M(H
2O)
6]n+
, con n = 2 ó 3 y tienen estructura octaédrica. Las moléculas de agua actúan como bases de Lewis, donando un par de electrones al ion metálico y formando un enlace covalente dativo con él. En la siguiente tabla se enumeran ejemplos típicos:
| Complejo | color | Config. electrónica | Distancia M−O (Å)[3] | Intercambio de agua Velocidad (s−1, 25 °C)[4] |
Autointercambio M2+/3+ Velocidad(M−1s−1, 25 °C) |
|---|---|---|---|---|---|
| [Ti(H 2O) 6]3+ |
violeta | (t2g)1 | 2.025 | 1.8·105 | |
| [V(H 2O) 6]2+ |
violeta | (t2g)3 | 2.12[5] | 8.7·101}} | rápido |
| [V(H 2O) 6]3+ |
verde | (t2g)2 | 1.991[6] | 5.0·102 | rápido |
| [Cr(H 2O) 6]2+ |
azul | (t2g)3(eg)1 | 2.06 and 2.33 | 1.2·108 | lento |
| [Cr(H 2O) 6]3+ |
violeta | (t2g)3 | 1.961 | 2.4·10-6 | lento |
| [Mn(H 2O) 6]2+ |
rosa pálido | (t2g)3(eg)2 | 2.177 | 2.1·107 | |
| [Fe(H 2O) 6]2+ |
azul-verdoso pálido | (t2g)4(eg)2 | 2.095 | 4.4·106 | rápido |
| [Fe(H 2O) 6]3+ |
violeta pálido | (t2g)3(eg)2 | 1.990 | 1.6·102 | rápido[7] |
| [Co(H 2O) 6]2+ |
rosa | (t2g)5(eg)2 | 2.08 | 3.2·106 | |
| [Ni(H 2O) 6]2+ |
verde | (t2g)6(eg)2 | 2.05 | 3.2·104 | |
| [Cu(H 2O) 6]2+ |
azul | (t2g)6(eg)3 | 1.97 y 2.30 | 5.7·109 | |
| [Zn(H 2O) 6]2+ |
incoloro | (t2g)6(eg)4 | 2.03-2.10 | rápido |
Las sales de Tutton son compuestos cristalinos con la fórmula genérica(NH
4)
2M(SO
4)
2·(H
2O)
6 (donde M = V2+, Cr2+, Mn2+, Co2+, Ni2+, or Cu2+). Los alumbres, MM′(SO4)2(H2O)12, también son sales dobles. Ambos conjuntos de sales contienen cationes metálicos hexa-aquo.
Complejos tetra-aquo
editarLas formas de plata (I) [Ag(H
2O)
4]+
, son un raro ejemplo de un complejo acuoso tetraédrico.[2] Se creía que el paladio (II) y el platino (II) formaban complejos acuosos planos cuadrados.[8]
Complejos octa- y nona-aquo
editarLos aquocomplejos de iones lantánido (III) son 8 y 9-coordinados, lo que refleja el gran tamaño de los centros metálicos.
Complejos binucleares-acuosos
editar2(OH
2)
10]4+ : rojo = O, blanco = H, azul = Co.
En el ion binuclear [Co
2(OH
2)
10]4+, cada molécula de agua puente dona un par de electrones a un ion de cobalto y, otro par, al otro ion de cobalto. Las longitudes de enlace Co-O (puente) son 213 picómetros, y las longitudes de enlace Co-O (terminal) son 10 pm más cortas.[9]
Los complejos [Mo
2(H
2O)
8]4+ y [Rh
2(H
2O)
10]4+ contienen enlaces metal-metal.[2]
Complejos hidroxo y oxo de iones aquo
editarNo se han reportado complejos acuosos monoméricos de Nb, Ta, Mo, W, Mn, Tc, Re y Os en estados de oxidación +4 a +7.[8] Por ejemplo, [Ti(H
2O)
6]4+ es desconocida: la especie hidrolizada [Ti(OH)
2(H
2O)
n]2+ es la especie principal en soluciones diluidas. Con estados de oxidación más altos, la carga eléctrica efectiva en el catión se reduce aún más por la formación de oxocomplejos.
Complejos acuosos de cationes lantánidos
editarLas sales de lantánidos a menudo, o quizás de manera característica, forman aquocomplejos. Los aquocomplejos tricatiónicos homolépticos tienen nueve ligandos de agua.[10]
Reacciones
editarAlgunas reacciones consideradas fundamentales para el comportamiento de los aquacomplejos son el intercambio de ligandos, la transferencia de electrones y las reacciones ácido-base.
Intercambio de agua
editarEl intercambio de agua es un intercambio de ligando que implica el reemplazo de un ligando de agua ("agua coordinada") con agua en solución ("agua bruta"). A menudo el proceso se representa utilizando agua etiquetada como H
2O·:
En ausencia de marcado isotópico, la reacción es degenerada, lo que significa que el cambio de energía libre es cero. Las velocidades varían en muchos órdenes de magnitud. El principal factor que afecta la cinética es la carga: los cationes metálicos altamente cargados intercambian su agua más lentamente que los cationes con una sola carga. Por lo tanto, las velocidades de intercambio para [Na(H
2O)
6]+
y [Al(H
2O)
6]3+ difieren en un factor de 109. La configuración electrónica también es un factor importante, como lo ilustra el hecho de que las velocidades de intercambio de agua para [Al(H
2O)
6]3+ y [Ir(H
2O)
6]3+ también difieren en un factor de 109.[4] El intercambio de agua generalmente sigue una vía de sustitución disociativa, por lo que las constantes de velocidad indican reacciones de primer orden.
Intercambio de electrones
editarEsta reacción generalmente se da en la interconversión de iones metálicos divalentes y trivalentes, que implica el intercambio de un solo electrón. El proceso se llama autointercambio, lo que significa que el ion parece intercambiar electrones consigo mismo. El potencial de electrodo estándar para el siguiente equilibrio:
- [M(H
2O)
6]2+ + [M'(H
2O)
6]3+ ⇌ [M(H
2O)
6]3+ + [M'(H
2O)
6]2+
muestra la creciente estabilidad del estado de oxidación inferior a medida que aumenta el número atómico. El valor muy grande del par de manganeso es una consecuencia del hecho de que el manganeso(II) octaédrico tiene una energía de estabilización del campo cristalino (CFSE) de cero, pero el manganeso(III) tiene 3 unidades de CFSE.[11]
Utilizando marcadores para realizar un seguimiento de los metales, el proceso de autointercambio se describe como:
Las velocidades de intercambio de electrones varían enormemente, y las variaciones se pueden atribuir a diferentes energías de reorganización: cuando los iones 2+ y 3+ difieren ampliamente en estructura, las velocidades tienden a ser lentas. [12] La reacción de transferencia de electrones se desarrolla a través de una transferencia de electrones de esfera exterior. Muy a menudo, las grandes energías de reorganización están asociadas con cambios en la población del nivel eg, al menos para los complejos octaédricos.
Reacciones ácido-base
editarLas disoluciones de complejos metálicos acuosos son ácidas debido a la ionización de protones de los ligandos de agua. En solución diluida, el aquacomplejo de cromo (III) tiene un pKa de aproximadamente 4,3, lo que produce un hidroxocomplejo metálico:
- [Cr(H
2O)
6]3+ ⇌ [Cr(H
2O)
5(OH)]2+ + H+
Por tanto, el ion aquo es un ácido débil, de fuerza comparable al ácido acético (pKa de aproximadamente 4,8). Este pKa es típico de los iones trivalentes. La influencia de la configuración electrónica sobre la acidez se demuestra por el hecho de que [Ru(H
2O)
6]3+ (pKa = 2.7) es más ácido que [Rh(H
2O)
6]3+ (pKa = 4), a pesar de que se espera que Rh(III) sea más electronegativo. Este efecto está relacionado con la estabilización del ligando hidróxido donador pi por el centro (t2g)5 Ru(III).[2]
En disoluciones concentradas, algunos hidroxocomplejos metálicos experimentan reacciones de condensación, conocidas como olación, para formar especies poliméricas. Se supone que muchos minerales se forman mediante olación. Los iones acuosos de los iones metálicos divalentes son menos ácidos que los de los cationes trivalentes.
Las especies hidrolizadas (aquellas que han perdido por lo menos una molécula de agua del complejo) a menudo exhiben propiedades muy diferentes del complejo hexaaquo precursor. Por ejemplo, la velocidad de intercambio de agua en [Al(H
2O)
5OH]2+ es 20000 veces más rápido que en [Al(H
2O)
6]3+.
Véase también
editar- Número de hidratación
- Teoría del campo de ligandos
Referencias
editar- ↑ Mark I. Ogden and Paul D. Beer "Water & O-Donor Ligands" in Encyclopedia of Inorganic Chemistry, Wiley-VCH, 2006, Weinheim. doi 10.1002/0470862106.ia255
- ↑ a b c d Lincoln, S. F.; Richens, D. T.; Sykes, A. G. (2003). «Metal Aqua Ions». Comprehensive Coordination Chemistry II. Comprehensive Coordination Chemistry II 1. pp. 515-555. ISBN 9780080437484. doi:10.1016/B0-08-043748-6/01055-0.
- ↑ Para Mn(II), Fe(II), Fe(III):Sham, T. K.; Hastings, J. B.; Perlman, M. L. (1980). «Structure and Dynamic Behavior of Transition-Metal Ions in Aqueous Aolution: an EXAFS Study of Electron-Exchange Reactions». J. Am. Chem. Soc. 102 (18): 5904-5906. doi:10.1021/ja00538a033.. Para Ti(III), V(III), Cr(III): Kallies, B.; Meier, R. (2001). «Electronic Structure of 3d [M(H2O)6]3+ Ions from ScIII to FeIII: A Quantum Mechanical Study Based on DFT Computations and Natural Bond Orbital Analyses». Inorg. Chem. 40 (13): 3101-3112. PMID 11399179. doi:10.1021/ic001258t.
- ↑ a b Helm, Lothar; Merbach, André E. (2005). «Inorganic and Bioinorganic Solvent Exchange Mechanisms». Chemical Reviews 105 (6): 1923-1959. PMID 15941206. doi:10.1021/cr030726o.
- ↑ Cotton, F. A.; Falvello, L. R.; Llusar, R.; Libby, E.; Murillo, C. A.; Schwotzer, W. (1986). «Synthesis and Characterization of Four Vanadium(II) Compounds, Including Vanadium(II) Sulfate Hexahydrate and Vanadium(II) Saccharinates». Inorganic Chemistry 25 (19): 3423-3428. doi:10.1021/ic00239a021.
- ↑ Cotton, F. A.; Fair, C. K.; Lewis, G. E.; Mott, G. N.; Ross, F. K.; Schultz, A. J.; Williams, J. M. (1984). «Precise Structural Characterizations of the Hexaaquovanadium(III) and Diaquohydrogen Ions. X-ray and Neutron Diffraction Studies of [V(H2O)6][H5O2](CF3SO3)4». Journal of the American Chemical Society 106 (18): 5319-5323. doi:10.1021/ja00330a047.
- ↑ Grant, M.; Jordan, R. B. (1981). «Kinetics of Solvent Water Exchange on Iron(III)». Inorganic Chemistry 20: 55-60. doi:10.1021/ic50215a014.
- ↑ a b Persson, Ingmar (2010). «Hydrated Metal Ions in Aqueous Solution: How Regular are Their Structures?». Pure and Applied Chemistry 82 (10): 1901-1917. doi:10.1351/PAC-CON-09-10-22.
- ↑ Han, Yin-Feng; Li, Min; Wang, Tian-Wei; Li, Yi-Zhi; Shen, Zhen; Song, You; You, Xiao-Zeng (2008). «A Novel Microporous Hydrogen-Bonding Framework Constructed with Tetrathiafulvalene Tetracarboxylate Ligand: Synthesis, Structure and Magnetic Properties». Inorganic Chemistry Communications 11 (9): 945-947. doi:10.1016/j.inoche.2008.04.028.
- ↑ Parker, David; Dickins, Rachel S.; Puschmann, Horst; Crossland, Clare; Howard, Judith A. K. (2002). «Being Excited by Lanthanide Coordination Complexes: Aqua Species, Chirality, Excited-State Chemistry, and Exchange Dynamics». Chemical Reviews 102 (6): 1977-2010. PMID 12059260. doi:10.1021/cr010452+.
- ↑ Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. ISBN 0-85312-027-7. p. 236.
- ↑ Wilkins, R. G. (1991). Kinetics and Mechanism of Reactions of Transition Metal Complexes (2 edición). Weinheim: VCH. ISBN 1-56081-125-0.


